Pengertian
Perubahan entalpi reaksi (ΔH) adalah perubahan energi dari awal hingga akhir suatu reaksi kimia.
Rumus
Dengan Kalorimetri
\[Q = m \cdot c \cdot ΔT\]
\[Q = C \cdot ΔT\]
Keterangan :
Q = Jumlah Kalor (Joule)
m = Massa Zat (gram)
c = Kalor Jenis
C = Kapasitas Kalor
ΔT = Selisih suhu
Dengan data ΔH Ikatan
\[ΔH = \sum ΔH_{reaktan} – ΔH_{produk}\]
Dengan Hukum Hess
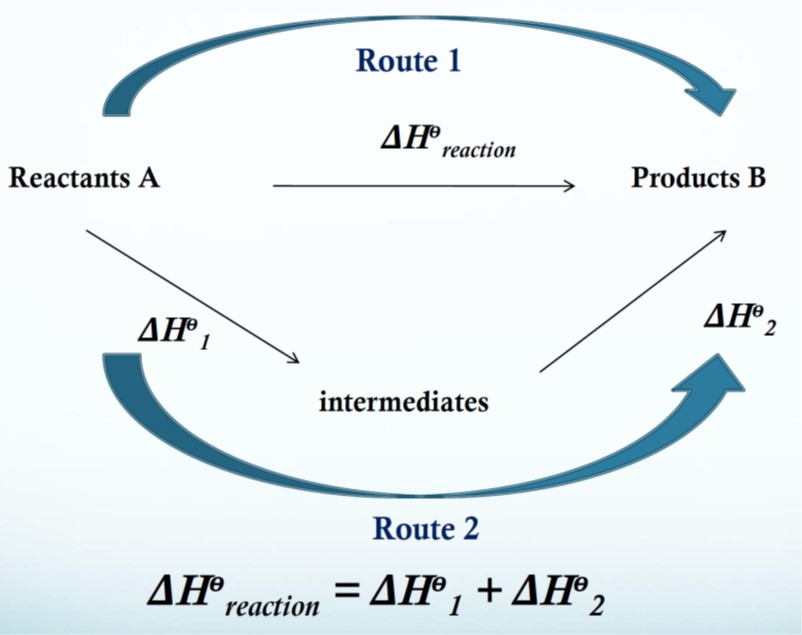
\[ΔH = ΔH_1 + ΔH_2\]
Contoh
Soal dengan kalorimeter
Air sebanyak 5 kg bersuhu 10oC dipanaskan hingga bersuhu 30oC. Jika kalor jenis air 4.186 J/kgoC, maka tentukan kalor yang diserap air tersebut?
Pembahasan :
\[Q = m \cdot c \cdot ΔT\]
\[Q = 5\ kg \cdot 4.186 \ J/kg^oC \cdot (30-10)^oC\]
\[Q = 418.600\ J\]
Soal Energi Ikatan
Data nilai energi ikatan rata-rata diketahui sebagai berikut.
| Ikatan | Energi Ikatan (kJ mol–1 ) |
| C–H | 400 |
| C–Cl | 300 |
| Cl–Cl | 200 |
| H–Cl | 450 |
C2H6(g) + Cl2(g) → C2H5Cl(g) + HCl(g)
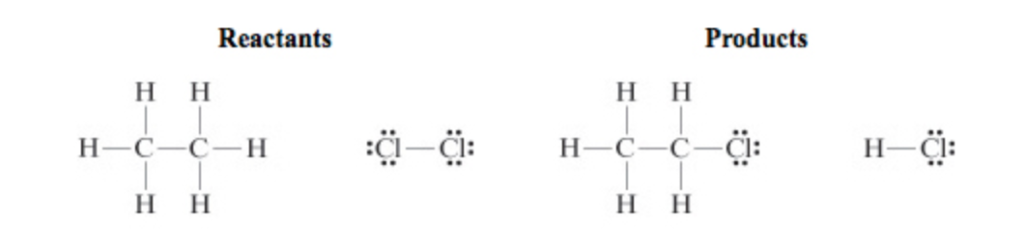
Nilai entalpi reaksi di atas adalah ….
\[ΔH = \sum ΔH_{reaktan} – ΔH_{produk}\]
\[ΔH = ({400 + 200}) – ({300 + 450})\]
\[ΔH = {600} – {750}\]
\[ΔH = -150\]